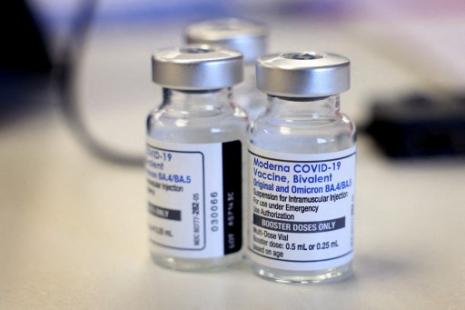
L’Agence européenne du médicament (EMA) a recommandé hier l’approbation du vaccin Comirnaty adapté aux sous-variants d’Omicron BA.4 et BA.5, douze jours après avoir donné son feu vert aux versions adaptées à BA.1 de Pfizer-BioNTech et de Moderna. La Haute Autorité de santé (HAS) doit se prononcer dans les prochains jours pour définir l’utilisation de ces vaccins en France.
L’EMA avait promis un avis sur les vaccins adaptés aux sous-variants BA.4 et BA.5 à la mi-septembre. C’est chose faite. Hier, le régulateur européen a recommandé l’approbation du vaccin de Pfizer-BioNTech adapté aux deux sous-variants majoritaires ces derniers mois, comme l’avait fait son homologue américain, la FDA, le 31 août 2022. Elle ne s’est en revanche pas encore prononcée sur le vaccin adapté de Moderna.
Cette nouvelle version de Comirnaty est un vaccin bivalent, composé de la souche historique et de BA.4/5. Il est destiné aux personnes âgées de 12 ans déjà primo-vaccinées. Le Comité des médicaments à usage humain (CHMP) de l’EMA s’est notamment appuyé sur les récentes données cliniques qui lui ont permis de recommander la version de Comirnaty adapté à BA.1 pour donner son feu vert à la version adaptée à BA.4/5.
L’avis a été transmis à la Commission européenne pour décision. Devrait ensuite être rendu l’avis de la Haute Autorité de santé (HAS) quant à l’utilisation de ces vaccins adaptés. En effet, celle-ci a indiqué le 5 septembre qu’elle rendrait un « avis global sur les vaccins bivalents » à la mi-septembre, de façon à bénéficier de l’examen réalisé par l’EMA sur les versions adaptées à BA.4/5. Elle avait alors précisé que ces vaccins bivalents seraient « disponibles en France en octobre (…) pour la campagne de vaccination à l’automne ». Pour leur part, l’EMA et le Centre européen de prévention et de contrôles des maladies (ECDC) ont préconisé, le 6 septembre, leur utilisation en rappel vers les personnes les plus vulnérables et/ou exposées, à savoir les personnes âgées, les femmes enceintes et les professionnels de santé, les vaccins monovalents utilisant la souche originale restant recommandés en primovaccination.

Dispensation du médicament
Tramadol et codéine sur ordonnance sécurisée : mesure reportée !
Formation continue
Transmission automatique des actions de DPC : les démarches à faire avant le 30 novembre
Relocalisation industrielle
Gel des prix sur le paracétamol pendant 2 ans : pourquoi, pour qui ?
Salon des maires
Trois axes d’action pour lutter contre les violences à l’officine